アミロイドβを標的とした抗体薬レカネマブは,アルツハイマー病による軽度認知障害(MCI)および軽度認知症の治療薬として臨床応用されています.JAMA Neurology誌にワシントン大学から,治療を導入した234名の治療後の経過を検討した研究が報告されています.
対象患者は平均年齢74.4歳,CDRスコア0.5(MCI)または1(軽度認知症)の診断で,治療期間の平均は6.5か月でした.CDR-SB(臨床的認知機能評価のサブスコア)変化率は年間1.11ポイント(軽度認知症では1.56,MCIでは0.99)でした.副作用に関しては,インフュージョンリアクションは全体の37%に発生しましたが,多くは軽度でした.一方,注目されるアミロイド関連画像異常(ARIA)は,234人中194人が評価され,42人(22%)に認められました.そのうち,11人(5.7%)が症候性ARIAを発症し,2人(1.0%)は入院を要する重篤な症状を呈しましたが,死亡例や大出血はありませんでした.症候性ARIAを発症した11人の患者のうち,8人は症状が完全に回復しました.残る3人では,軽度の失語・混乱,慢性頭痛の増悪,精神症状の悪化といった後遺症がみられました.治療を中止したのは全体の9.8%(23人)であり,そのうちARIA関連の中止は4.3%(10人)でした.
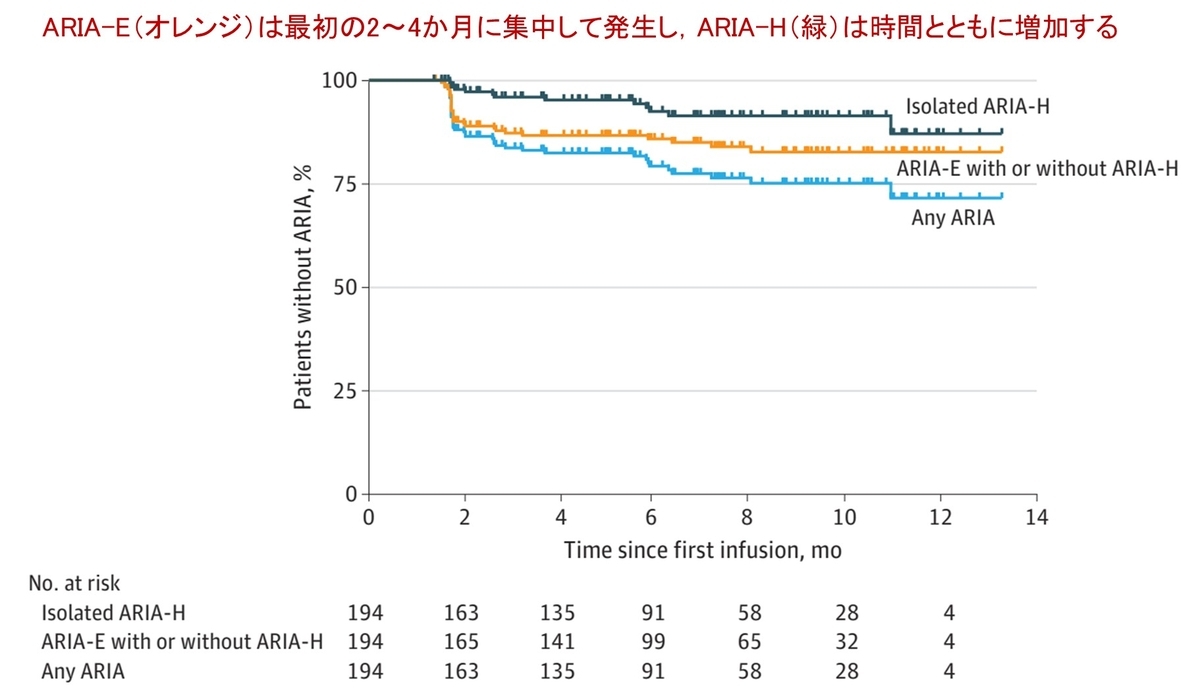
この研究でもっとも印象的だったのは図1で,ARIAが時間経過とともにどのように出現するのか視覚的に分かります.治療開始後,ARIA-E(浮腫;オレンジ)は早期(最初の2〜4か月)に集中して発生し,その後の出現頻度は低下します.一方,ARIA-H(微小出血など;緑)のみを呈する症例は時間とともに徐々に増加していく様子が明らかになりました.つまりすでに周知されているように,開始初期のMRIモニタリングは重要ですが,ARIA-Hは治療期間を通して注意する必要があると言えます.
また,CDR 1の患者では症候性ARIAの発生率が27%と高く,CDR 0.5の患者(1.8%)に比べて15倍もリスクが高いことが示されました.症候性ARIAを呈した患者の多くは回復したものの,上述した通り,3人に後遺症(失語,頭痛,精神症状の増悪)が残存し,治療中止に至った例もみられました.つまりCDR 1の患者に対しては,副作用の頻度と重症度が相対的に高くなることを踏まえた協働意思決定(shared decision making)が必要になると考えられます.とくにAPOE ε4ホモ接合体である患者ではリスクが高くなるため(ホモ接合でのARIA-Eの頻度は38%),治療開始にあたっては,リスクとベネフィットを明確に説明し,共に考える姿勢が必要だと思います.
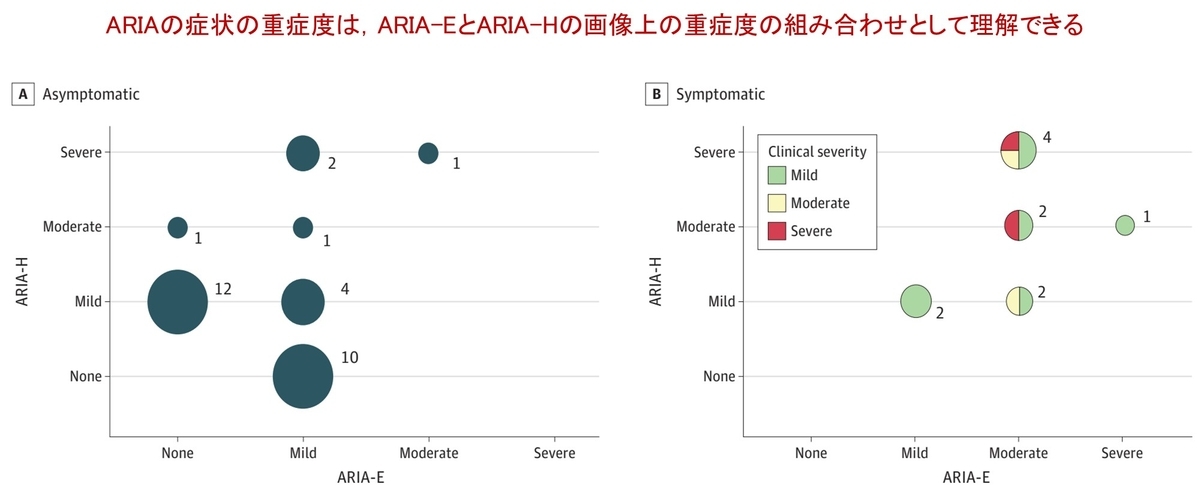
また図2も重要です.ARIA-EとARIA-Hの画像上の重症度を縦軸と横軸に取り,それらの組み合わせにおいて,患者が症候性であったか無症候性であったかを可視化しています.無症候性ARIA(図2A)の多くは,軽度〜中等度のARIA-Eと軽度のARIA-Hにとどまりました.一方,症候性ARIAはすべてARIA-EとARIA-Hの両方を有しており,とくに症状が重篤である症例(赤)では,中等度以上のARIA-Eと中等度以上のARIA-Hの組み合わせで認めることが分かりました.
研究の限界は,ほとんどが白人であり,人種的多様性に欠けている点と,単一施設でのデータである点かと思います.
個人的な疑問としては,ARIAを来しても多くは治療継続可能であることが示されましたが,ARIA後も単なる可逆的副作用と考えて継続した方が良いのか,それとも警告発作と考えたほうが良いのか(つまり再発や進行はないのか),明らかにする必要があると思いました.いずれにせよ,本研究はレカネマブのリアリワールドにおける安全性データを示すとともに,患者さんに対する科学的根拠に基づいた協働意思決定を支援するという現代医療のあり方に繋がると思います.本剤を処方する医師はよく理解しておく必要がある論文だと思います.
Paczynski M, et al. Lecanemab Treatment in a Specialty Memory Clinic. JAMA Neurology. Published online May 12, 2025.(doi.org/10.1001/jamaneurol.2025.1232)