自己免疫性脳炎(autoimmune encephalitis:AE)は特定の自己抗体が機能障害を引き起こし,記憶障害やけいれん,運動異常症,精神症状など多様な症候を呈します.早期の免疫療法によって改善が望めるものの,十分なエビデンスに基づく治療はまだ確立されていません.このため,現在,AEに対する新しい免疫療法の臨床試験が国際的に進められています.これらを分かりやすく解説した総説がNeurology誌に掲載されています.代表的な4つの試験と,なぜそれらの薬剤が選ばれたのかが理解できます.
【現在進行中の主要な臨床試験】
① EXTINGUISH試験
対象:NMDAR抗体陽性の成人および青年
治療薬:イネビリズマブ(CD19陽性B細胞・一部形質芽細胞を標的)
② LEGIONE試験
対象:LGI1抗体陽性の成人
治療薬:ロザノリキシズマブ(FcRn阻害)
③ CIELO試験
対象:NMDARまたはLGI1抗体陽性の新規例および難治例
治療薬:サトラリズマブ(IL-6受容体阻害)
④ GENERATE-BOOST試験
対象:重症の細胞表面抗原抗体陽性例(リツキシマブ使用後)
治療薬:ボルテゾミブ(プロテアソーム阻害薬)
【病態と薬剤選定の理由】
図1では,AEがどのような要因で発症し,どの免疫細胞が関与しているかが示されています.誘因には特発性,腫瘍,ウイルス感染後,医原性(免疫チェックポイント阻害薬)があり,発症にはHLAや自己免疫疾患体質,炎症促進の環境が関係します.免疫病態の中心にはT細胞,B細胞,自己抗体があり,これらが大脳皮質,辺縁系,基底核,小脳,脳幹を標的にして多彩な症候を引き起こします.
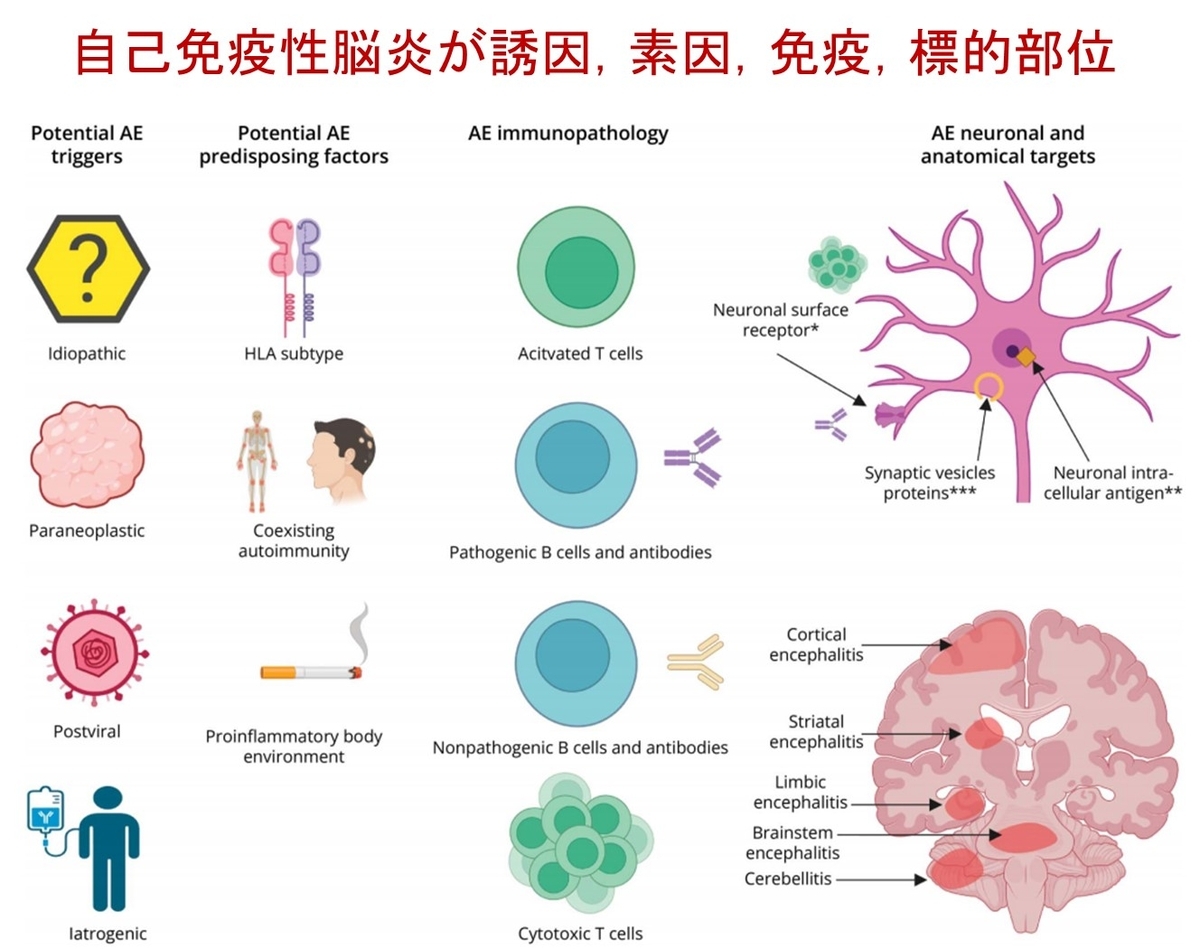
図2では,免疫応答の各段階における治療薬の作用点が示されています.抗原提示細胞がT細胞を活性化し,それがB細胞を刺激.IL-6の助けを借りてB細胞が形質芽細胞に分化し,病原性抗体を産生.産生された抗体は血中や脳脊髄液中に放出され,血液脳関門を通過して中枢神経へ到達.細胞表面抗原と結合し,受容体等の内在化・機能阻害・細胞障害を引き起こす.さらにT細胞の浸潤,ミクログリアの活性化,サイトカイン(IL-6など)放出,これらの結果として中枢神経系での炎症性環境が形成される.さらにB細胞から形質芽細胞,形質細胞へと至る過程で,髄腔内で抗体が産生され,これが機能障害を引き起こす.
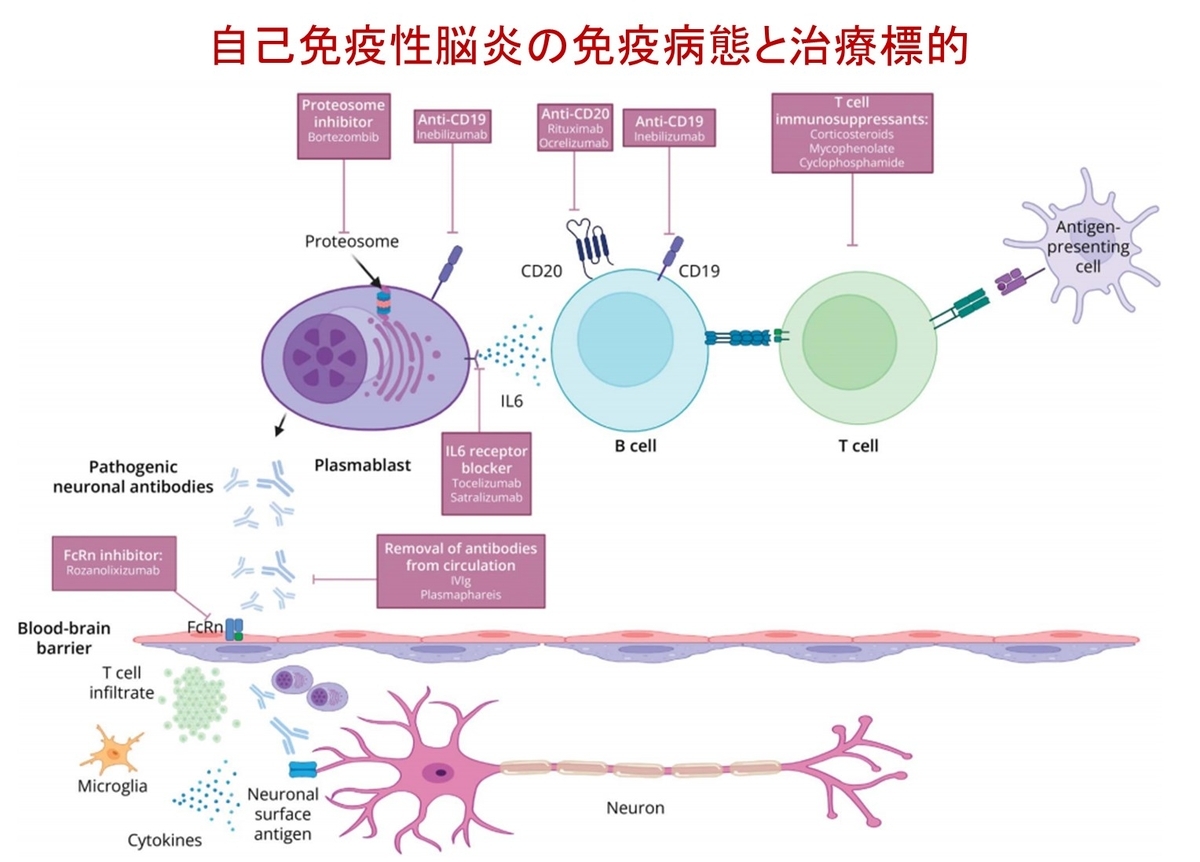
種々の薬剤は,この免疫カスケードの異なる段階を標的にしています:
◆ステロイド,IVIg,血漿交換(非特異的免疫抑制)
◆抗CD20抗体(リツキシマブ):B細胞除去
◆抗CD19抗体(イネビリズマブ):B細胞に加え一部の形質芽細胞も標的
◆プロテアソーム阻害薬(ボルテゾミブ):形質細胞をアポトーシスへ導く
◆FcRn阻害薬(ロザノリキシズマブ):IgGの再利用を防ぎ,病原性抗体を減少させる
◆IL-6受容体阻害薬(サトラリズマブ):形質芽細胞への分化を抑制
脳炎ごとにどの過程を抑制するのが最も効果的なのか明らかにする必要があります.
【AEの臨床試験における共通課題】
臨床試験の実施にあたっての課題も記載されています.
1.症例数の少なさ
2.疾患の多様性
抗体の種類や病態が異なるため,対象を広げると効果が不明確になり,絞ると対象が少なくなるというジレンマがある.このためCIELO試験ではバスケット試験を行っている.
3.アウトカム評価の難しさ
AE特有の認知機能障害や睡眠,自律神経症状などを十分に評価できるスケールがない.
4.標準治療との関係性
ステロイドやリツキシマブなど既存治療が既に広く使われており,これらを使用している患者をどう扱うかが設計上の課題となる.
以上のように,AEの治療は免疫病態を正しく理解したうえで適切なターゲットを治療する時代へと移行しつつあります.現在進行中の臨床試験はその先駆けと言えます.一方,希少疾患に特有の課題を克服するためには,研究者・医療者・患者さんが一体となった取り組みが求められると思いました.
Titulaer MJ, et al. The Clinical Trial Landscape in Autoimmune Encephalitis: Challenges and Opportunities. Neurology. 2025;104:e213487. https://www.neurology.org/doi/10.1212/WNL.0000000000213487